El ciclo de Carnot se produce
cuando un equipo que trabaja absorbiendo una cantidad de calor Q1 de la fuente de alta temperatura y
cede un calor Q2 a la
de baja temperatura produciendo un trabajo sobre el
exterior. El rendimiento viene
definido, como en todo ciclo, por
y, como se verá adelante, es
mayor que cualquier máquina que funcione cíclicamente entre las mismas fuentes
de temperatura. Una máquina térmica que realiza
este ciclo se denomina máquina de Carnot.
Como todos los procesos que
tienen lugar en el ciclo ideal son reversibles, el ciclo puede invertirse.
Entonces la máquina absorbe calor de la fuente fría y cede calor a la fuente
caliente, teniendo que suministrar trabajo a la máquina. Si el objetivo de esta
máquina es extraer calor de la fuente fría se denomina máquina frigorífica, y si es aportar calor a la
fuente caliente, bomba
de calor.
Figura 1.1 Ciclo de Carnot
Se define ciclo de Carnot como un proceso cíclico reversible que utiliza
un gas perfecto, y que consta de dos transformaciones isotérmicas y dos
adiabáticas, tal como se muestra en la figura.
Figura 1.2 Ciclo de Carnot
La representación gráfica del ciclo de Carnot en un diagrama p-V es el
siguiente
|
|
Tramo A-B isoterma a la
temperatura T1
Tramo
B-C adiabática
Tramo
C-D isoterma a la temperatura T2
Tramo
D-A adiabática
|
En cualquier ciclo, tenemos que obtener a partir de los datos iniciales:
- La presión, volumen de cada uno de los
vértices.
- El trabajo, el calor y la variación de energía
interna en cada una de los procesos.
- El trabajo total, el calor absorbido, el calor
cedido, y el rendimiento del ciclo.
Los datos iniciales son los que figuran en la tabla adjunta. A partir de
estos datos, hemos de rellenar los huecos de la tabla.
Variables
|
A
|
B
|
C
|
D
|
Presión p (atm)
|
pA
|
|||
Volumen v (litros)
|
vA
|
vB
|
||
Temperatura T (K)
|
T1
|
T1
|
T2
|
T2
|
Para conseguir la máxima eficiencia la
máquina térmica que estamos diseñando debe tomar calor de un foco caliente,
cuya temperatura es como máximo Tc y verter el
calor de desecho en el foco frío, situado como mínimo a una temperatura Tf.
Para que el ciclo sea óptimo, todo el calor absorbido debería tomarse a
la temperatura máxima, y todo el calor de desecho, cederse a la temperatura
mínima. Por ello, el ciclo que estamos buscando debe incluir dos procesos
isotermos, uno de absorción de calor a Tc y uno de
cesión a Tf.
Para conectar esas dos isotermas (esto es, para calentar el sistema
antes de la absorción y enfriarlo antes de la cesión), debemos incluir procesos
que no supongan un intercambio de calor con el exterior (ya que todo el
intercambio se produce en los procesos isotermos). La forma más sencilla de
conseguir esto es mediante dos procesos adiabáticos reversibles (no es la única
forma, el motor de Stirling utiliza otro método, la
recirculación). Por tanto, nuestra máquina térmica debe constar de cuatro
pasos:
·
C→D Absorción de calor Qc en un proceso
isotermo a temperatura Tc.
·
D→A Enfriamiento adiabático hasta la temperatura del foco frío, Tf.
·
A→B Cesión de calor | Qf | al foco
frío a temperatura Tf.
·
B→C Calentamiento adiabático desde la temperatura del foco frío, Tf a
la temperatura del foco caliente,Tc.
Las etapas del ciclo
- Transformación A->B (isoterma)
La presión pB se calcula a partir de la
ecuación del gas ideal
- Transformación B->C (adiabática)
 La ecuación de estado adiabática es
La ecuación de estado adiabática es  o bien, . Se despeja vc de
la ecuación de la adiabática.
o bien, . Se despeja vc de
la ecuación de la adiabática. Conocido vc y T2 se obtiene pc, a partir de la ecuación del gas ideal. .
- Transformación C->D (isoterma)
- Transformación D-> A (adiabática)
 . Conocido vD y T2 se
obtiene pD, a partir de la ecuación del gas ideal.
. Conocido vD y T2 se
obtiene pD, a partir de la ecuación del gas ideal. .
.
El ciclo completo
- Variación de energía interna
En un proceso cíclico reversible la variación de energía interna es cero
- Trabajo
 , lo que nos conduce a la expresión
final para el trabajo.
, lo que nos conduce a la expresión
final para el trabajo.Calor
En la isoterma T2 se cede calor Q<0
ya que vD<vC
- Rendimiento del ciclo
Se define rendimiento como el cociente entre el trabajo realizado y el
calor absorbido
Aplicaciones del ciclo de cannot.
Dos importantes áreas
de aplicación de la termodinámica son la generación de potencia y
refrigeración. Ambas se llevan a cabo por sistemas que operan mediante un ciclo
termodinámico. Estos ciclos pueden ser divididos en dos categorías generales:
ciclos de potencia y ciclos de refrigeración.
Los dispositivos o
sistemas empleados para producir una salida de potencia neta reciben el nombre
de maquinas, y los ciclos termodinámico en los que opera se denominan ciclos de
potencia.
Las aplicaciones del
Primer principio de la termodinámica están escritos acorde con el Criterio de
signos termodinámico. Los cuales hacen referencia a los intercambios de energía entre un sistema
y su entorno, en forma de calor y trabajo,según la IUPAC (International Union
of Pure and Applied Chemistry), es el siguiente:
·
Positivo para el trabajo y el calor entregado al
sistema.
·
Negativo para el trabajo y el calor cedido por
el sistema.
Los primeros son los de aplicación a
máquinastérmicas, y recorren los diagramas típicos de representación ( p-v
,T-s,h-s) ensentido horario. Los ciclos inversos son de aplicación a máquinas
frigoríficas yrecorren los diagramas típicos ( p-h,h-s) en sentido antihorario.











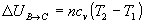










No hay comentarios:
Publicar un comentario